El fuego como 'herbívoro' global: la ecología
y evolución de
ecosistemas inflamables
William J. Bond1 and Jon E. Keeley2,3
1Department of Botany, University of Cape Town,
Rondebosch, South Africa
2U.S.GeologicalSurvey,Western Ecological ResearchCenter,Sequoia-Kings
CanyonNational Parks,ThreeRivers,CA93271-9651,USA
3Department of Ecology and Evolutionary Biology, University of
California, Los Angeles, CA 90095, USA
Es difícil encontrar referencias al fuego en general, en
libros de texto sobre ecología, biología de la conservación o biogeografía, a
pesar del hecho de que gran parte del mundo se quema de forma regular, y que
hay una considerable literatura sobre la ecología del fuego y su uso para el
manejo de ecosistemas. El fuego ha estado quemando ecosistemas durante cientos
de millones de años, ayudando a dar forma global a la distribución del bioma y
para mantener la estructura y función de las comunidades propensas a incendios.
El fuego también es un fuerza evolutiva significativa, y es uno de los primeras
herramientas que los humanos usaron para remodelar su mundo. Aquí, revisamos la
literatura reciente, trazando paralelismos entre el fuego y los herbívoros como
consumidores alternativos de vegetación. Señalamos las preguntas comunes y
algunas respuestas sorprendentemente diferentes, que surgen de considerar el
fuego como un consumidor de importancia mundial análogo a la herbivoría.
Paralelos entre
fuego y herbivoría
Los ecologistas y biogeógrafos asumen generalmente que distribución
vegetal, abundancia y, por tanto, comunidad composición, estructura y biomasa,
se determinan principalmente por el clima y los suelos. Esto está implícito en
los intentos actuales de modelar los cambios de distribución de especies en
respuesta al cambio climático. [1]. Sin embargo, hace casi 50 años, Hairston et
al. [2] sugirió que las propiedades de los ecosistemas en cambio, están
determinadas por la regulación de los herbívoros por depredadores. En ausencia
de depredadores, las poblaciones de herbívoros proliferaría, consumiendo
cantidades tan grandes de vegetación que las comunidades de plantas serían
transformadas a las tolerantes a la herbivoría en lugar de a los más capaz de
competir por los recursos. Los críticos afirmaron que las plantas terrestres
son en gran parte incomestibles de modo que, incluso sin depredadores, los
herbívoros rara vez podrían consumir suficiente para transformar ecosistemas
[3]. Los efectos del fuego son, en muchos sentidos, análogos a los de la
herbivoría, pero han faltado en la literatura sobre ecología trófica. Aunque
generalmente se trata como una perturbación, el fuego difiere de otras
perturbaciones, como ciclones o inundaciones, en que se alimenta de moléculas
orgánicas complejas (al igual que los herbívoros) y los convierte en productos
orgánicos y minerales.
El fuego difiere de la herbivoría en que regularmente
consume materia viva y muerta y, sin proteínas necesarias para su crecimiento,
tiene amplias preferencias dietéticas. Plantas que son no comestible para los
herbívoros comúnmente alimenta los incendios. ¿Cómo encaja el fuego, sin las
limitaciones de la baja calidad de los alimentos, predicciones de Hairston et
al. [2] como consumidor del ecosistema que no está restringido por
depredadores? Aquí, discutimos el ecología de ecosistemas inflamables,
utilizando el término "Control del consumidor" para los ecosistemas
en los que los incendios o herbívoros alterar significativamente la biomasa, la
mezcla de formas de crecimiento de las plantas, y composición de especies en
los ecosistemas. Sostenemos que el control del consumidor es importante desde
el punto de vista ecológico y biogeográfico.
y evolutivamente cuando el consumidor es fuego.

Control de
incendios y consumidores de ecosistemas Polis
[3], en una revisión de la hipótesis del "mundo verde", argumentó que
la vegetación terrestre está determinada en gran medida por clima, modificado
localmente por suelos bajos en nutrientes, con control del consumidor por
herbívoros a veces ocurre pero estar localizado en el espacio y el tiempo.
¿Cómo puede el global importancia de los consumidores (herbívoros e incendios)
versus recursos (clima y suelos) en la configuración de la vegetación evaluado?
Una alternativa útil a los metanálisis de estudios experimentales (a menudo
limitados en espacio, tiempo, sesgo taxonómico y recuentos de reportajes) es
comparar propiedades del ecosistema potenciales versus reales para un
determinado localidad. Si un ecosistema difiere mucho de sus recursos limitados
propiedades potenciales, entonces es un candidato para "Control del
consumidor", ya sea por herbivoría o por fuego (Figura 1). Los incendios
frecuentes reducen la altura del plantas dominantes (Figura 2) y, por tanto, la
posición, pero no necesariamente la cantidad, de hojas y dosel fotosíntesis
Biomasa vegetal leñosa, en lugar de primaria productividad, es por tanto la
medida más reveladora de control del consumidor por fuego. El problema es cómo
medir biomasa potencial, la "capacidad de carga" de los árboles en un
sitio, contra los cuales se pueden medir los ecosistemas reales.

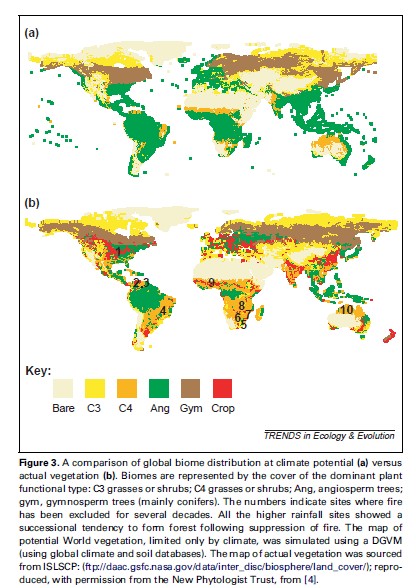
Control de
incendios y consumidores de la composición de especies Las cascadas tróficas, medidas como grandes cambios en
la composición de especies, son una consecuencia esperada de la eliminación de
depredadores en ecosistemas donde los consumidores tienen el potencial de
proliferar en su ausencia. Aunque la evidencia de cascadas tróficas en
ecosistemas terrestres es discutida [7], los cambios en cascada en la
composición de especies son comunes donde el fuego es el consumidor. Por
ejemplo, en los bosques tropicales, un solo incendio puede reducir la riqueza
de las plantas leñosas de un tercio a dos tercios, dependiendo de la severidad
del fuego y puede tener impactos negativos en una diversa gama de componentes
de la fauna [12-15]. Cambios en la distribución de combustible y El microclima
después de un incendio forestal tropical aumenta la probabilidad de más
incendios y la conversión de bosques en matorrales y pastizales [12,15]. Por el
contrario, para los ecosistemas con una larga historia de incendios, existe
preocupación por las consecuencias en cascada de la extinción antropogénica de
incendios. En praderas de pastos altos y pastizales comparables en otros
lugares, la extinción de incendios ha provocado la pérdida de hasta el 50% de
las especies de plantas [16,17]. Las plantas herbáceas pequeñas con altos
requisitos de luz para el crecimiento y el establecimiento de las plántulas son
las más afectadas. También se han informado cambios en la composición de la
fauna, por ejemplo, en bosques secos de dipterocarpos, donde la extinción de
incendios ha provocado una pérdida marcada de especies de termitas [18]. Se
producen pérdidas de especies aún mayores cuando la extinción de incendios
conduce a cambios completos de bioma, como de sabanas a bosques [19,20]. Hay,
hasta ahora, no existe una síntesis global de la rotación de especies en
diferentes ecosistemas y bajo diferentes regímenes de incendios después de la
liberación o extinción de incendios. Esperaríamos un continuo de respuestas del
reemplazo casi completo de especies después de cambios de bioma a cambios
insignificantes en ecosistemas donde los incendios, aunque predecibles, son
poco frecuentes. Los incendios de Yellowstone de 1988, por ejemplo, no causaron
pérdida o ganancia de especies en este paisaje [21]. Por lo tanto, todavía no
es posible trazar un mapa global para mostrar la extensión de los ecosistemas
cuya composición de especies cambiaría significativamente si se suprimieran los
incendios.
La naturaleza
variable del fuego como control del consumidor
Los ecosistemas inflamables incluyen bosques boreales,
bosques de eucaliptos, matorrales, pastizales y sabanas. ¿Por qué, si el fuego
es un consumidor tan influyente, existe tal diversidad de formas de crecimiento
en los ecosistemas inflamables? Los ecologistas de incendios han buscado
primero respuestas en la diversidad de regímenes de incendios. Un régimen de
incendios incluye los patrones de frecuencia, estación, tipo, gravedad y
extensión de los incendios en un paisaje (Cuadro 1).

La vegetación consumida y los patrones de propagación
del fuego varían según el paisaje, y los diferentes regímenes de fuego producen
diferentes patrones de paisaje y seleccionan diferentes atributos de las
plantas. De ello se desprende que los cambios en los regímenes de incendios,
dentro de un paisaje determinado, deberían tener importantes consecuencias para
el ecosistema. Considere los bosques de coníferas del suroeste de América del
Norte. En estos paisajes semiáridos, los bosques han sido moldeados durante
mucho tiempo por un régimen de incendios de frecuentes incendios superficiales
de intensidad relativamente baja (baja altura y temperatura de la llama). Estos
bosques comparten atributos con los pastizales subtropicales en el sentido de
que los incendios son provocados por frecuentes rayos al comienzo de la
temporada de monzones, cuando los combustibles están más secos. Sin embargo, la
productividad primaria en los bosques de coníferas es menor que en las sabanas
mésicas debido a su mayor aridez y esto se traduce en menor frecuencia de
incendios, menor intensidad de incendios y mayor heterogeneidad en los
"patrones de alimentación" del fuego [22]. Como consecuencia, existen
oportunidades para el establecimiento ocasional de árboles que persisten para
formar bosques de baja densidad. Los incendios exhiben una especie de
"herbivoría selectiva", que consume biomasa herbácea de la
superficie, pero deja intactos los árboles dominantes de los pisos superiores.
Tras el asentamiento humano a principios del siglo XX, estos paisajes de
coníferas se han gestionado con una política de extinción total de incendios,
que es un experimento fortuito sobre cómo el fuego controla la estructura de la
vegetación y ha resultado en una exclusión casi total del fuego. Los bosques
que se queman naturalmente a un ritmo de una o dos veces por década llevan más
de un siglo sin quemar [23], lo que ha provocado cambios importantes en la
estructura y función de los ecosistemas. La densidad de árboles ha aumentado en
un orden de magnitud o más, con pérdidas importantes en el sotobosque herbáceo
y la diversidad de especies. Además, la ausencia de fuego ha provocado cambios
en muchos componentes del ecosistema. De profunda importancia para el manejo es
el hecho de que la extinción de incendios ha conducido a la acumulación de
combustible y esto ha puesto al bosque en una trayectoria diferente de tal
manera que, cuando los incendios ocurren, ahora se alimentan como 'monstruos'
que consumen bosques masivos, en lugar de como herbívoros terrestres. La mayor
parte del trabajo sobre regímenes de incendios se limita a paisajes y
ecosistemas particulares. No existe una síntesis global sobre lo que determina
los regímenes de incendios en los ecosistemas mundiales. Todavía no entendemos
las sinergias y la importancia relativa de la ignición, los períodos secos, las
propiedades de la vegetación como combustible o las barreras topográficas a la
propagación del fuego para determinar qué regímenes de incendios ocurren y
dónde. Esto socava seriamente nuestra capacidad para predecir las consecuencias
del cambio global para los ecosistemas afectados por el fuego o para
interpretar cambios pasados en la distribución de ecosistemas inflamables. Lo
que está claro es que diferentes regímenes de fuego seleccionan para diferentes
atributos de la planta y regímenes de fuego similares seleccionan para
atributos similares. Los ecologistas de la sabana en todo el mundo encuentran
rasgos vegetales similares con respuestas similares al fuego [24]. Los
ecologistas que trabajan en matorrales de tipo mediterráneo encuentran rasgos
vegetales convergentes relacionados con el fuego en diferentes continentes [25,
26], pero estos son diferentes de los de las sabanas. Pasar de un régimen de
incendios a otro parece ser tan difícil como encontrar puntos en común entre la
herbivoría de insectos y mamíferos, porque la biología de los
"organismos" es muy diferente.
Fuego y la
formación de comunidades
Hairston y col. [2] predijo relativamente poca
competencia entre plantas donde los herbívoros proliferan en ausencia de
depredadores, porque el crecimiento de las plantas estaría más limitado por el
consumo que por los recursos. En cambio, los conjuntos comunitarios
comprenderían especies que son más capaces de persistir y prosperar frente a la
defoliación repetida. Una de las características sorprendentes de la literatura
sobre ecología del fuego es que hay muchos estudios sobre los rasgos de la
historia de vida que permiten la persistencia de especies en un régimen de
incendios dado (Cuadro 2), pero pocos sobre la adquisición de recursos y la
competencia. La coherencia con las predicciones de Hairston et al. [2], esa
competencia será de menor importancia en los ecosistemas controlados por el
consumidor, parece haber pasado desapercibida. Los rasgos de la planta que son
importantes para la persistencia del fuego. son diferentes en comunidades que experimentan
diferentes regímenes de fuego. En regímenes de fuego de copa, donde se consume
toda la biomasa leñosa, existen numerosos estudios sobre el modo de
recuperación de la quema (brote vegetativo o no brote), el reclutamiento
estimulado por el fuego, el tiempo hasta la primera reproducción y la
persistencia de los bancos de semillas hasta el próximo incendio [20,26,27].
Estos rasgos de las plantas, junto con los patrones de consumo de fuego,
especialmente su frecuencia, se utilizan ampliamente para predecir conjuntos de
especies compatibles [26, 28]. Sin embargo, la pertenencia a la comunidad rara
vez se atribuye a interacciones competitivas con otras especies de plantas,
excepto cuando esas especies cambian el régimen de perturbación [29]. En
regímenes de fuego de superficie, como las sabanas, los incendios se alimentan
selectivamente, consumiendo plantas en la capa de hierba pero no árboles de más
de 2–4 m. La coexistencia de árboles y pastos se ha atribuido a la
diferenciación de nichos, siendo los pastos los competidores más exitosos por
los recursos en la superficie del suelo y los árboles que acceden a los
recursos en capas más profundas del suelo [30]. Una idea alternativa,
consistente con los ecosistemas controlados por el consumidor, es que la
cubierta arbórea es limitado por cuellos de botella demográficos en diferentes
etapas de la historia de vida en el crecimiento de los árboles [30, 31]. El
fuego sería una de las causas principales de estos cuellos de botella en las
sabanas quemadas con frecuencia, lo que reduciría el establecimiento de
plántulas y evitaría que las plántulas emerjan de la "trampa de
fuego", la llama. zona producida por incendios de pastos. Los herbívoros
vertebrados tienen efectos análogos, suprimiendo las plántulas por ramoneo
intenso con raras explosiones de reclutamiento cuando las plantas se liberan de
la herbivoría [32]. La hipótesis de la diferenciación de nicho no predice
cambios en la cobertura arbórea debido al fuego supresión (o exclusión de
herbívoros) porque la cubierta arbórea está limitada por la competencia de
recursos. Pero muchos experimentos de exclusión de incendios a largo plazo
(Figura 2) muestran que la cubierta de árboles está limitada por el fuego. En
estos casos, el control del consumidor, más que la competencia por los
recursos, determina la cobertura arbórea [33].
Recuadro 1. Regímenes de incendios
Gill [61]
introdujo el concepto de régimen de incendios, que hemos modificado para
incluir: (i) el consumo de combustible y los patrones de propagación del fuego;
(ii) intensidad; (iii) severidad; (iv) frecuencia; y (v) estacionalidad.
Consumo de combustible y propagación del fuego Los incendios consumen una
variedad de tipos de combustible, lo que tiene un impacto profundo en los
ecosistemas. Los incendios superficiales se propagan por combustibles que están
cerca del suelo, como la hierba o el material de hojas y tallos muertos,
mientras que los incendios de copas arden en las copas de los arbustos y
asociaciones dominadas por árboles. Los incendios de tierra queman suelos ricos
en materia orgánica. Pueden encenderse con los rayos y arder sin llama durante
largos períodos hasta que los cambios en el clima favorezcan los incendios de
superficie o de corona. Algunos bosques tienen una mezcla heterogénea de
incendios superficiales, incendios de copas y parches no quemados, lo cual es
importante para los procesos del ecosistema, como el reclutamiento de árboles.
Por ejemplo, en los bosques mixtos de coníferas de Sierra Nevada en California,
las zonas de incendios de alta intensidad producen huecos de luz que son
importantes para la regeneración de los árboles [62]. Estos huecos también
acumulan combustibles a un ritmo más lento y, por lo tanto, tienen una mayor
probabilidad de ser pasados por alto por los incendios hasta que los árboles
jóvenes alcancen un tamaño suficiente para resistirlos [63]. La importancia
ecológica del tamaño del fuego varía con el ecosistema y también con las
diferentes especies del sistema. Por ejemplo, los matorrales de chaparral
comúnmente experimentan grandes incendios de copas que pueden desnudar completamente
decenas de miles de hectáreas. Esto no representa una amenaza para las especies
de plantas en estos ecosistemas porque la regeneración depende por completo de
procesos endógenos (Recuadro 2). Sin embargo, los bosques mixtos de coníferas
del oeste de Estados Unidos son potencialmente más sensibles al tamaño del
fuego. Históricamente, estos bosques se han quemado con una mezcla de incendios
superficiales, que dejaron vivos a los árboles dominantes, e incendios de
copas, que mató a todos los árboles dentro de pequeños parches desde unos pocos
cientos de metros cuadrados hasta unos pocos cientos de hectáreas. La
reproducción de los árboles dominantes requiere huecos generados por los
incendios de copas, pero deben estar a una distancia de dispersión de los
árboles padres. Cuando los fuegos de copa son muy grandes, la regeneración se
ve afectada negativamente. Intensidad La intensidad del fuego se refiere a la
liberación de energía o, más libremente, a otras medidas directas de
calentamiento o comportamiento del fuego, como la longitud de la llama y la
velocidad de propagación. La intensidad de la línea de fuego, que es la energía
por longitud de frente de fuego, se utiliza cada vez más como estándar para la
intensidad del fuego.
Gravedad
Aunque la intensidad
del fuego es una medida de inmensa importancia para el fuego combatientes, los
ecologistas suelen estar más interesados en la gravedad del fuego, en general
definido como una medida del impacto del ecosistema. En ecosistemas boscosos,
la mortalidad de los árboles se utiliza comúnmente como medida de la gravedad
del fuego; sin embargo, se utilizan otras métricas en los matorrales donde se
consumen todas las plantas aéreas.
Frecuencia
La frecuencia
de incendios es la ocurrencia de incendios para un área y período de tiempo de
interesar. Hay complicaciones al evaluar la frecuencia de incendios que
implican un comportamiento complejo del fuego a diferentes escalas espaciales
con diferentes limitaciones. El intervalo de rotación del fuego es el tiempo
necesario para quemar el equivalente de un área específica, mientras que el
intervalo de retorno del fuego es el tiempo intervalo entre incendios en
cualquier sitio [10].
Temporada
La temporada de
incendios está dictada por la coincidencia de encendidos y bajo nivel de
humedad de combustible. Esta suele ser la época más seca del año, que varía con
clima regional. En muchos ecosistemas, los seres humanos han alterado
enormemente temporada de incendios al proporcionar igniciones fuera de la
tormenta eléctrica natural período.
El fuego como
agente evolutivo Hay pocos estudios sobre la
evolución de los rasgos adaptativos al fuego, y muchos rasgos de las plantas
han sido etiquetados acríticamente como 'adaptaciones al fuego' sin ningún
análisis riguroso en cuanto a la importancia funcional del rasgo o su origen
filogenético. Por ejemplo, el brote posterior a la quemadura a menudo se
considera una "adaptación al fuego", pero el brote per se es un rasgo
generalizado en las angiospermas. Interpretaciones evolutivas de la pérdida o
ganancia de brotes en diferentes regímenes de fuego no tiene sentido sin un
análisis filogenético [34,35]. Entre los nuevos estudios más convincentes se
encuentran los que exploran la evolución de la inflamabilidad. En un debate en
el que se hizo eco de si las plantas han evolucionado para promover la
herbivoría (y es igualmente controvertido), los ecologistas han preguntado si
las plantas en ecosistemas mantenidos por el fuego han evolucionado en la
inflamabilidad. ¿Existen beneficios para las plantas inflamables que superen
los costos de supervivencia de una quema más feroz? La teoría predice que la
inflamabilidad podría, de hecho, evolucionar si el fuego se propagara desde una
planta inflamable para matar a sus vecinas, y si la progenie de mutantes más
inflamables tuviera más probabilidades de reclutarse en los huecos creados. [36,37].
En estos modelos, la inflamabilidad actúa como un rasgo de "construcción
de nicho" [38,39], modificando el entorno local en beneficio del genotipo
inflamable. Esta hipótesis hace la predicción comprobable de que la morfología
inflamable y el reclutamiento estimulado por fuego deben ser rasgos
correlacionados, y hay cierto apoyo para esta predicción en pinos [40]. En
Pinus, la serotina (la retención de semillas en conos que se abren después de
un incendio), un rasgo de reclutamiento del fuego, se correlaciona con la
retención de ramas muertas, un rasgo de inflamabilidad. Las plantas que
retienen ramas muertas tienen más probabilidades de llevar un fuego al dosel
que las plantas que se podan por sí solas. Schwilk y Ackerly [41] probaron si
estos rasgos mostraban una evolución correlacionada en la filogenia del pino.
Utilizando un conjunto de filogenias de 'superárboles', los autores encontraron
un fuerte apoyo para la asociación predicha entre la serotina y la retención de
ramas muertas, y también entre estos y otros rasgos morfológicos 'que abarcan
el fuego', como corteza delgada, edad de maduración temprana y más inflamables
follaje, que se esperaría en estos regímenes de fuego que reemplazaran [40].
Sería interesante explorar la evolución de la inflamabilidad en otros taxones y
otros ecosistemas. ¿La "construcción de nichos", a través de la
evolución de la inflamabilidad de las especies comunes, ha jugado un papel en
la propagación de las formaciones inflamables en las que están contenidas? Los
estudios de la evolución de los rasgos y los orígenes de la flora leñosa de las
sabanas se ven obstaculizados por nuestra falta de comprensión de los rasgos
clave necesarios para sobrevivir en regímenes de incendios alimentados con
pasto. Los rasgos que son comunes en los regímenes de fuego de copa son raros o
están ausentes en las sabanas [40]. En ecosistemas herbáceos productivos, los
incendios son demasiado frecuentes para proporcionar los sitios para las
plántulas y el reclutamiento de plántulas estimulado por el fuego, incluida la
serotinia, parecen ser una excepción. Los incendios son demasiado frecuentes
para la evolución de leñosos que no brotan y la brotación es la norma
[31,42,43]. Los árboles que sobreviven a los incendios antropogénicos en los
bosques tropicales tienden a ser los que tienen una corteza aislante más gruesa
[12]. Aunque los árboles de las sabanas suelen tener una corteza gruesa, la
regeneración de nuevas plantas es quizás el principal obstáculo para el
mantenimiento de las poblaciones. Las plántulas y los árboles jóvenes enfrentan
frecuentes y severos daños por incendios en las sabanas mésicas. Entre
incendios, las semillas tienen que germinar y las plántulas deben adquirir
reservas de yemas y raíces para rebrotar y sobrevivir al próximo incendio. Dado
que los incendios ocurren varias veces en una década, las plántulas deberían
adquirir la capacidad de rebrotar rápidamente. Un estudio reciente en Brasil
confirma esta conjetura [44]. Las únicas diferencias consistentes entre las
plántulas de especies hermanas de los hábitats de bosques y sabanas fue la
mayor asignación a raíces gruesas, asociada con la brotación, en las especies
de sabana y más respuestas plásticas a la luz [44].
Los incendios frecuentes también seleccionan una forma
peculiar de crecimiento de los retoños, con tallos en forma de postes y raíces
subterráneas hinchadas (Figura 4, [45, 46]). El vástago en forma de poste
facilita el atornillado rápido hacia una altura que está fuera del alcance de
los incendios superficiales y las raíces proporcionan los recursos para
rebrotar si el tallo no alcanza un tamaño a prueba de fuego antes de la
siguiente quema. Los árboles jóvenes pueden quedar atrapados en la zona de
llamas durante décadas. En el pino de hoja larga, Pinus palustris, del sureste
de los Estados Unidos, los árboles jóvenes se disparan solo una vez y la
mortalidad de los árboles jóvenes inducida por el fuego es alta [47] presumiblemente
porque carecen de reservas de raíces comparativamente grandes. En el
polimórfico. Los árboles jóvenes africanos, Acacia karroo, formadores de postes
se encuentran en sabanas frecuentemente quemadas, mientras que las plantas
forman arquitecturas en forma de jaula donde no se producen incendios [46]
(Figura 4). Las arquitecturas de árboles jóvenes contrastantes sugieren
trayectorias evolutivas alternativas cuando las plantas están expuestas a la
selección por diferentes tipos de consumidores (es decir, fuego versus
navegadores).
El fuego y el
origen de los biomas
La gran superficie ocupada por biomas inflamables,
especialmente en los trópicos y subtrópicos, a menudo se ha atribuido a la
quema antropogénica. Aunque los incendios antropogénicos han extendido áreas de
vegetación inflamable [48,49], ahora hay evidencia de que los incendios
naturales ocurrieron mucho antes que los humanos y que los ecosistemas
inflamables son anteriores a la quema antropogénica en millones de años [4,50].
Estable La evidencia isotópica muestra que los ecosistemas herbáceos C4, la
formación inflamable más extensa del mundo, aparecieron por primera vez entre
hace 6 millones de años (Ma) y 8 Ma [51]. Cerling y col. [51] planteó la
hipótesis de que esto se debía a la disminución del CO2 atmosférico, pero
estudios recientes de paleoatmósferas no apoyan su suposición de bajas
concentraciones de CO2 durante el Mioceno tardío [52,53]. La propagación de
pastos a menudo se ha atribuido a la coevolución con los mamíferos que pastan.
Sin embargo, es difícil ver cómo, al consumir pasto, los pastores promoverían
la expansión de los pastizales a expensas de los bosques. Por el contrario, se
sabe que los incendios alimentados con pastos promueven la propagación de
ecosistemas herbáceos al excavar agujeros en los bosques [29]. Los fuertes
candidatos para alimentar los incendios son los pastos C4 altamente inflamables
y productivos de los trópicos húmedos, que comenzaron a reemplazar los bosques
desde finales del Terciario en adelante [54-56].
Recuadro
2. Historias de vida moldeadas por el fuego
De los muchos
rasgos que pueden interpretarse como de importancia funcional en entornos
controlados por incendios, dos han captado la mayor atención: la brotación y el
reclutamiento de plántulas provocado por el fuego. Brotante es la regeneración
vegetativa que se produce tras la destrucción de tejidos vivos. Esto puede ser
de raíces o tallos después de la muerte de todos los tejidos de la superficie,
o a lo largo de los tallos donde las ramas han muerto. La germinación es un
rasgo generalizado en las especies leñosas y no está estrechamente relacionado
con los ambientes propensos al fuego [35]. Una excepción es Pinus, un género en
el que la brotación es rara y aparentemente deriva de los ecosistemas de fuego
de copa [40]. Sin embargo, brotar de lignotubérculos basales que se producen
como una etapa de desarrollo normal es una combinación que se encuentra mucho
más comúnmente en ecosistemas de clima mediterráneo propensos a incendios [25].
El brote en el contexto de otras características de la historia de vida
representa patrones complejos que se han revisado recientemente en otro lugar
[35]. Muchas especies en ambientes propensos a incendios con incendios que
reemplazan a los rodales tienen el reclutamiento de plántulas restringido al
primer año posterior al incendio [20, 27]. En los matorrales inflamables del
hemisferio sur, muchas especies producen frutos serotinosos que se abren
después del fuego y dispersan semillas que germinan fácilmente después de las
lluvias de la estación húmeda [64]. En matorrales comparables del hemisferio
norte, la serotina es relativamente rara. En ambos hemisferios, muchas especies
producen semillas que están inactivas y se acumulan en el suelo. La germinación
es provocada por el calor o el humo (o la madera quemada) [65]. La germinación
estimulada por calor ocurre típicamente en especies de semillas duras que
tienen una barrera física en la cubierta de la semilla para la absorción de
agua. La germinación se desencadena por el choque térmico del fuego o por las
altas temperaturas del suelo en sitios abiertos. Existe un patrón filogenético
marcado en el que ciertas familias de plantas están asociadas con un modo u
otro; por ejemplo, la germinación estimulada por calor está muy extendida en
Fabaceae, Cistaceae, Convolvulaceae y Sterculiaceae, y falta la germinación
estimulada por humo [65]. La germinación estimulada por calor está generalizada
en numerosos ecosistemas propensos a incendios. La germinación estimulada
químicamente es provocada por el humo y / o la madera carbonizada. Hasta ahora,
se ha encontrado que es importante sólo en tres matorrales de clima
mediterráneo, el chaparral de California [65], fynbos sudafricanos [66] y
brezales australianos [67]. En California, las familias de plantas en las que
se encuentra este modo de germinación generalmente no son las mismas que en los
matorrales del hemisferio sur, lo que indica que este rasgo podría haber
evolucionado de manera convergente. La floración estimulada por el fuego es otro
mecanismo para el reclutamiento de plántulas después de la quema [20]. La
floración ocurre en el primer año posterior al incendio en los rebrotes de
bulbos o rizomas, seguida de un abundante reclutamiento de plántulas en el
segundo año posterior al incendio. La mayoría de las especies continúan
floreciendo esporádicamente en años posteriores, por lo que no hay una
dependencia obligada del fuego para florecer. Una excepción es el geófito
fynbos sudafricano Cyrtanthus ventricosus, que germina a los pocos días de un
incendio, independientemente de la estación, y permanece inactivo hasta que la
floración es estimulada nuevamente por el humo de otro incendio [68]. No todas
las especies en ambientes propensos al fuego tienen historias de vida que hayan
sido moldeadas por el fuego. En los matorrales de las cuencas californianas y
mediterráneas, muchas especies tienen un reclutamiento de plántulas que está
restringido a condiciones libres de fuego [69]. Tienen un conjunto de
características reproductivas, que incluyen el comportamiento de la dispersión
y la germinación de semillas, que son bastante distinta de las especies con
reclutamiento de plántulas estimulado por el fuego. En ambos ecosistemas
[69,70], estos tipos que no son de fuego son de linajes más antiguos y se
derivan de taxones que se originaron en un clima diferente. Eso Se ha sugerido
que estos rasgos ya no son adaptativos y representan efectos históricos y
procesos de clasificación de especies [70]. Una visión alternativa es que estos
síndromes de historia de vida están adaptados a hábitats que todavía existen en
paisajes propensos a incendios, y la coexistencia de La variabilidad natural en
la frecuencia de los incendios promueve la variabilidad natural en la
frecuencia de los incendios [69].
Estudios recientes en Australia
relacionan el fuego con el origen y la propagación de los biomas de ese
continente. Bowman [11] se propuso explicar la distribución de los pequeños
fragmentos de "selva tropical" distribuidos como un archipiélago en los
vastos mares de formaciones de eucaliptos. Las selvas tropicales son
formaciones cerradas de árboles intolerantes al fuego con especies de
sotobosque tolerantes a la sombra. Por el contrario, las formaciones de
eucalipto soportan suelos de hierba o arbustos inflamables que no toleran la
sombra. Parches de bosque anómalos similares en una matriz de pastizales
inflamables están muy extendidos en África y América del Sur [4,57].
Generaciones de ecologistas han debatido los determinantes de estos tipos de
biomas alternativos, citando la aridez, el fuego, los suelos pobres en
nutrientes y la quema antropogénica. Bowman evaluó críticamente la evidencia para
todos estos para Australia. Ambos biomas se encuentran a través de un amplio
gradiente de lluvia y la "selva tropical" (un nombre inapropiado) se
agota donde la lluvia cae por debajo de 600 mm yK1. Contrariamente a la
percepción popular, las formaciones inflamables no son "áridas". De
hecho, los eucaliptos son menos tolerantes a la sequía que muchos árboles de la
selva tropical que comparten el mismo clima [11]. Bowman concluyó que la única
diferencia consistente entre los árboles de las dos formaciones estaba en su
respuesta al fuego: los eucaliptos tienen una capacidad notable para sobrevivir
y prosperar bajo incendios frecuentes, mientras que los árboles de la selva
tropical mueren por quema repetida [11,58]. La implicación es que si pudiera
"apagar" los incendios durante un largo suficiente tiempo, grandes
áreas de Australia soportarían una flora de "selva tropical"
completamente diferente. Este proceso está en marcha en formaciones húmedas de
eucaliptos, donde los incendios se han reducido y las selvas están invadiendo
[59]. Sin embargo, el reemplazo en todo el continente es poco probable porque
la tasa de colonización de la selva tropical es lenta en climas más secos y en
suelos pobres en nutrientes en comparación con la frecuencia de los incendios
[59]. Estudios moleculares sistemáticos recientes han descubierto que la
estructura filogenética de las leguminosas se debe tanto al entorno ecológico
como a la historia tectónica y la ubicación de las masas de tierra [60]. La
implicación es que la especiación y la posterior dispersión de algunos taxones
están confinadas ecológicamente, dentro de los biomas, tanto como por problemas
de dispersión a través de los océanos. La aparición de incendios alimentados
con pasto podría ser un ejemplo de un evento de "vicarianza"
intracontinental, segregando taxones en aquellos que podrían tolerar incendios
y aquellos que no. Las nuevas herramientas moleculares, junto con los estudios
ecológicos enfocados, prometen nuevos conocimientos sobre la historia evolutiva
de esas partes del mundo donde el fuego desacopla los biomas de su potencial
limitado por el clima.
Conclusiones
Hemos mostrado grandes similitudes
entre el fuego y la herbivoría y hemos abogado por una visión más inclusiva de
la vista descendente o, en este caso, el control de biomas por parte del
consumidor. Creemos que la extensión global del fuego como consumidor, sus muchos
paralelismos con la herbivoría, su papel en la selección de rasgos particulares
de las plantas y en la evolución de biomas, merece una atención mucho más
amplia por parte de los ecologistas. Existe un incentivo adicional para una
mayor comprensión del fuego como un consumidor de importancia mundial. El
cambio climático, la fragmentación del hábitat, el transporte sin precedentes
de plantas altamente inflamables a entornos novedosos y la superposición ubicua
de los impactos humanos sobre los regímenes de fuego exigen un nuevo nivel de
comprensión sintética para nuestra coexistencia pacífica con esta bestia
carismática.
Agradecimientos
Agradecemos
a Jeremy Midgley, C.J. Fotheringham, Ian Woodward, Guy Midgley, Ross Bradstock,
David Keith, Dave Bowman, Malcolm Gill, Alan Andersen y Herve Fritz para
discusiones útiles. Jeremy Midgley y revisores anónimos proporcionaron comentarios
útiles sobre el artículo.
References
1 Thomas, C.D. et al. (2004)
Extinction risk from climate change. Nature 427, 145–148
2 Hairston,
N. et al. (1960) Community structure, population control and competition. Am.
Nat. 94, 421–425
3 Polis,
G.A. (1999) Why are parts of the world green? Multiple factors control
productivity and the distribution of biomes. Oikos 86, 3–15
4 Bond,
W.J. et al. (2005) The global distribution of ecosystems in a world without
fire. New Phytol. 165, 525–538
5 Cramer,
W. et al. (2001) Global response of terrestrial ecosystem structure and
function to CO2 and climate change: results from six dynamic global vegetation
models. Glob. Change Biol. 7, 357–373
6 Woodward,
F.I. and Lomas, M.R. (2004) Vegetation dynamics – simulating responses to
climatic change. Biol. Rev 79, 643–670
7 Polis, G.A. et al. (2000) When
is a trophic cascade a trophic cascade? Trends Ecol. Evol. 15, 473–475
8 Barbosa,
P.M. et al. (1999) An assessment of fire in Africa (1981–1991): burnt areas,
burnt biomass and atmospheric emissions. Global Biogeochem. Cycles 13, 933–950
9 Dwyer, E.
et al. (2000) Characterization of the spatio-temporal patterns of global fire
activity using satellite imagery for the period April 1992 to March 1993. J.
Biogeogr. 27, 57–69
10 Agee,
J.K. (1993) Fire Ecology of Pacific Northwest Forests, Island Press
11 Bowman,
D.M.J.S. (2000) Australian Rainforests: Islands of Green in a Land of Fire,
Cambridge University Press 12 Cochrane, M.A. (2003) Fire science for
rainforests. Nature 421, 913–919
13 Cleary,
D.F.R. and Gennert, M.J. (2004) Changes in rain forest butterfly diversity
following major ENSO-induced fires in Borneo. Glob. Ecol. Biogeogr. 13, 129–140
14 Barlow,
J. and Peres, C.A. (2004) Ecological responses to El Nin˜ oinduced surface
fires in central Brazilian Amazonia: management implications for flammable
tropical forests. Philos. Trans. R. Soc. Lond. B Biol. Sci. 359, 367–380
15
Laurance, W.F. (2003) Slow burn: the insidious effects of surface fires on
tropical forests. Trends Ecol. Evol. 18, 209–212 16 Leach, M.K. and Givnish,
T.J. (1996) Ecological determinants of species loss in remnant prairies.
Science 273, 1555–1558
17 Uys, R.
et al. (2004) The effects of different fire regimes on plant diversity in
southern African grasslands. Biol. Conserv. 118, 489–499
18 Davies,
R.G. (1997) Termite species richness in fire-prone and fireprotected dry
deciduous dipterocarp forest in Doi Suthep-Pui National Park, northern
Thailand. J. Trop. Ecol. 13, 153–160
19
Peterson, D.W. and Reich, P.B. (2001) Prescribed fire in oak savanna: fire
frequency effects on stand structure and dynamics. Ecol. Appl. 11, 914–927
20 Bond,
W.J. and van Wilgen, B.W. (1996) Fire and Plants, Chapman & Hall
21 Turner,
M.G. et al. (2003) Surprises and lessons from the 1988 Yellowstone fires.
Front. Ecol. Env. 1, 351–358
22
Covington, W.W. and Moore, M.M. (1994) Southwestern ponderosa forest structure.
Changes since Euro-American settlement. J. For. 92, 39–47
23 Rollins,
M. et al. (2002) Landscape-scale controls over 20(th) century fire occurrence
in two large Rocky Mountain (U. S. A.) wilderness areas. Landscape Ecol. 6,
539–557
24 Scholes,
R.J. and Archer, S.R. (1997) Tree-grass interactions in savannas. Annu. Rev.
Ecol. Syst. 28, 517–544
25 Keeley,
J.E. (1986) Resilience of Mediterranean shrub communities to fire. In
Resilience in Mediterranean-type Ecosystems (Dell, B. et al., eds), pp. 95–112,
Dr. W. Junk
26 Pausas, J.G. et al. (2004)
Plant functional traits in relation to fire in crown-fire ecosystems. Ecology
85, 1085–1100
27 Whelan,
R.J. (1995) The Ecology of Fire, Cambridge University Press
28
Bradstock, R.A. and Kenny, B.J. (2003) Application of plant functional types to
fire management. J. Veg. Sci. 14, 345–354
29 Brooks,
M.L. et al. (2004) Effects of invasive alien plants on fire regimes. Bioscience
54, 677–688
30
Sankaran, M. et al. (2004) Tree-grass coexistence in savannas revisited:
insights from an examination of assumptions and mechanisms invoked in existing
models. Ecol. Lett. 7, 480–490
31 Higgins,
S.I. et al. (2000) Fire, resprouting and variability: a recipe for tree-grass
coexistence in savanna. J. Ecol. 88, 213–229
31 Higgins,
S.I. et al. (2000) Fire, resprouting and variability: a recipe for tree-grass
coexistence in savanna. J. Ecol. 88, 213–229
32 Prins,
H.H.T. and van der Jeugd, H.P. (1993) Herbivore population crashes and woodland
structure in East Africa. J. Ecol. 81, 305–314
33 Tilman,
D. et al. (2000) Fire suppression and ecosystem carbon storage. Ecology 81,
2680–2685
34 Verdu,
M. (2000) Ecological and evolutionary differences between Mediterranean seeders
and resprouters. J. Veg. Sci. 11, 265–268
35 Bond,
W.J. and Midgley, J.J. (2003) The evolutionary ecology of sprouting in woody
plants. Int. J. Plant Sci. 164 (Suppl. 3), S103–S114
36 Bond,
W.J. and Midgley, J.J. (1995) Kill thy neighbour: an individualistic argument
for the evolution of flammability. Oikos 73, 79–85
37 Kerr, B.
et al. (1999) Re-kindling an old flame: a haploid model for the evolution and
impact of flammability in resprouting plants. Evol. Ecol. Res. 1, 807–833
38
Odling-Smee, F.J. et al. (1996) Niche construction. Am. Nat. 147, 641–648
39 Schwilk,
D.W. (2003) Flammability is a niche construction trait: canopy architecture
affects fire intensity. Am. Nat. 162, 725–733
40 Keeley,
J.E. and Zedler, P.H. (1998) Evolution of life histories in Pinus. In Ecology
and Biogeography of Pinus (Richardson, D.M., ed.), pp. 219–249, Cambridge
University Press
41 Schwilk,
D.W. and Ackerly, D.D. (2001) Flammability and serotiny as strategies:
correlated evolution in pines. Oikos 94, 326–336
42 Hoffman,
W.A. (1998) Post-burn reproduction of woody plants in a neotropical
savanna: the relative importance of sexual and vegetative reproduction. J.
Appl. Ecol. 35, 422–433
43
Williams, R.J. et al. (1999) Fire regime, fire intensity and tree survival in a
tropical savanna in northern Australia. Aust. J. Ecol. 24, 50–59
44
Hoffmann,W.A. and Franco, A.C. (2003) Comparative growth analysis of tropical
savanna and forest trees using phylogenetically-independent contrasts. J. Ecol.
91, 475–484
45 Gignoux,
J. et al. (1997) Alternative fire resistance strategies in savanna trees.
Oecologia 110, 576–583
46
Archibald, S. and Bond, W.J. (2003) Growing tall vs. growing wide: tree
architecture and allometry of Acacia karroo in forest, savanna, and arid
environments. Oikos 102, 3–14
47
Glitzenstein, J.S. et al. (1995) Effects of fire regime and habitat on tree
dynamics in north Florida longleaf pine savannas. Ecol. Monogr. 65, 441–476
48 Pyne,
S.J. (2001) Fire: A Brief History, University ofWashington Press
49 Bowman,
D.M.J.S. (1998) The impact of Aboriginal landscape burning on the Australian
biota. New Phytol. 140, 385–410 50 Scott, A.C. (2000) The Pre-Quaternary
history of fire. Palaeogeogr. Palaeoclimatol. Palaeoecol. 164, 297–345
51 Cerling,
T.E. et al. (1997) Global vegetation change through the Miocene/Pliocene
boundary. Nature 389, 153–158
52 Pagani,
M. et al. (1999) LateMiocene atmospheric CO2 concentrations and the expansion
of C4 grasses. Science 285, 876–879
53 Pearson,
P.N. and Palmer, M.R. (2000) Atmospheric carbon dioxide concentrations over the
past 60 million years. Nature 406, 695–699
54 Keeley,
J.E. and Rundel, P.H. (2003) Evolution of CAM and C4 carbon concentrating
mechanisms in plants. Int. J. Plant Sci. 164 (Suppl. 3), S55–S77
55 Bond,
W.J. et al. (2003) The importance of low atmospheric CO2 and fire in promoting
the spread of grasslands and savannas. Glob. Change Biol. 9, 973–982
56 Sage,
R.F. (2001) Environmental and evolutionary preconditions for the origin and
diversification of the C4 photosynthetic syndrome. Plant Biol. 3, 202–213
57 Filho,
A.T. and Ratter, J.A. (2002) Vegetation physiognomies and woody flora of the
cerrado biome. In The Cerrados of Brazil (Oliveira, P.S. and Marquis, R.J.,
eds), pp. 91–120, Columbia University Press
58 Fensham, R.J. et al. (2003)
Effects of fire and drought in a tropical eucalypt savanna colonized by rain
forest. J. Biogeogr. 30, 1405–1414
59
Russell-Smith, J. et al. (2004) Rain forest invasion of eucalyptdominated
woodland savanna, Iron Range, north-eastern Australia: I. Successional
processes. J. Biogeogr. 31, 1293–1303
60 Lavin,
M. et al. (2004) Metacommunity process rather than continental tectonic history
better explains geographically structured phylogenies in legumes. Philos. Trans.
R. Soc. Lond. B Biol. Sci. 359, 1509–1522
61 Gill,
A.M. (1975) Fire and the Australian flora: a review. Aust. For. 38, 4–25
62
Stephenson, N.L. et al. (1991) Restoring natural fire to the sequoiamixed
conifer forest: should intense fire play a role? Proc. Tall Timbers Fire Ecol.
Conf 17, 321–337
63 Keeley,
J.E. and Stephenson, N.L. (2000) Restoring natural fire regimes in the Sierra
Nevada in an era of global change. InWilderness Science in a Time of Change
(Cole, D.N. et al., eds), pp. 255–265, USDA Forest Service
64 Lamont,
B.B. et al. (1991) Canopy seed storage in woody plants. Bot. Rev. 57, 277–317
65 Keeley,
J.E. and Fotheringham, C.J. (2000) Role of fire in regeneration from seed. In
Seeds: The Ecology of Regeneration in Plant Communities (Fenner, M., ed.), pp.
311–330, CABI
66 Brown,
N.A.C. et al. (2003) Patterns in the seed germination response to smoke in
plants from the Cape Floristic Region, South Africa. Sth. Afr. J. Bot 69,
514–525
67 Roche,
S. et al. (1998) For everything a season: smoke-induced seed germination and
seedling recruitment in a Western Australian Banksia woodland. Aust. J. Ecol.
23, 111–120
68 Keeley,
J.E. (1993) Smoke-induced flowering in the fire-lily Cyrtanthus ventricosus.
Sth. Afr. J. Bot. 59, 638
69 Keeley,
J.E. (1998) Coupling demography, physiology and evolution in chaparral shrubs.
In Landscape Disturbance and Biodiversity in Mediterranean-type Ecosystems
(Rundel, P.W. et al., eds), pp. 257–264, Springer
70 Herrera,
C.M. (1992) Historical effects and sorting processes as explanations for
contemporary ecological patterns: character syndromes in Mediterranean woody
plants. Am.
Nat. 140, 421–446


















